訳者序文
栄養学の研究には胡散臭いものが多い。その研究は時間と金がかかる割に評価が低い。金が集まらない。いきおい、食品業界が資金を提供する。援助を受けた研究者は業界に好都合な結果を出す。まさか、研究者ともあろうものが業界に不都合な結果を発表しないなんてと思うだろうが、業界は具合の悪い結果を出した研究者には2度と資金を提供しないのである。その結果、業界に都合のよい研究結果だけが集積する。酪農業界・乳業メーカーの「骨粗鬆症の予防に牛乳のカルシウムを!」という主張はこのような研究に基づく。
業界の主張に反対する少数派の研究者もいる。次に掲げる文章は「責任ある医学のための医師委員会(Physicains Committee for
Responsible Medicine)」のメンバーが発表した「乳製品によって子どもや若年成人の骨が丈夫になるという論説に根拠はあるか」という総説論文の全訳である。この論文は、牛乳のカルシウムで骨粗鬆症を予防しようというキャンペーンには根拠がないとする。この人たちも自分たちの主張に反する研究発表には目をつむっているかも知れない。ただ、この論文は、牛乳によって骨塩密度が増えたとする研究(文献番号34)をそれなりに評価している。ただし、この中国人少女に対する牛乳研究は、オーストラリアの酪農業界が出資している酪農の研究・開発会社(
DRDC)から資金提供を受けたものである。
抄録
目的:多くの国で、骨粗鬆症の予防のために1日当たり800-1500mgのカルシウムを主として乳・乳製品から摂るようにという勧告がなされている。しかし、疫学研究の多くは骨健康に対する乳製品の有効性に疑問を投げかけている。本論文は、子どもと若年成人において乳製品や総カルシウムの骨健康に与える影響を調べた今までの研究報告を評価して(1)カルシウム摂取に関する勧告を支持する証拠があるのか、(2)骨健康に対して、乳・乳製品が他の食品やプリメントより優れているという証拠はあるか、の2点を明らかにすることを目的として書かれている。
方法:米国医学図書館のメドラインを検索して、子どもと若年成人(1歳から25歳)について「牛乳、乳製品、あるいはカルシウム摂取量」と「骨塩量あるいは骨折リスク」の関係を報告している論文を選び出した。その結果、22編の横断研究、13編の後ろ向き研究、10編の前向き研究、13編の無作為割り付け介入研究、計58研究が評価対象論文として選択された。
結果:58編中11編は、体重、思春期発達度、運動量に関して補正していなかったので、評価対象から除外した。10編の無作為割り付け介入研究のうち9編は、カルシウムサプリメントによって子どもと青年期の骨塩増加にほどほどの効果があることを報告している。残りの37研究は乳製品からのカルシウムあるいはサプリメント以外の食事性カルシウム摂取を取り上げていたが、うち27編は乳製品あるいは食事性カルシウムと骨健康の間に何ら有意の関係を認めていない。9研究は効果があるとしていたがその影響はわずかであり、うち3研究はビタミンD強化牛乳によるビタミンDの影響を受けている。まとめると、臨床研究、横断研究、後ろ向き研究、前向き研究のいずれにおいても、総食事性カルシウムの摂取量(乳製品の摂取量)を増やしても、子どもと若年成人の骨健康に効果があるという一致した結論は得られていない。
結論:牛乳や乳製品の摂取量を増やして子どもと青年期の骨塩増加を図るという栄養ガイドラインを支持する証拠はほとんどない。
はじめに
過去20年にわたって米国衛生研究所、米国科学アカデミー、米国農務省は骨粗鬆症の予防という観点から子どもと成人のカルシウム摂取量に関する勧告を行ってきた。この勧告値は次第に上昇し、連邦政府の栄養政策は乳製品が好ましいカルシウム源として推奨してきた(1-6)。
しかしながら、アメリカの乳製品消費量は世界最高の水準にあり、乳製品のカルシウムは全食品からのカルシウム摂取量の72%に相当する6のに(6)、骨粗鬆症と骨折の発生も高率である(7,8)。このことから、多くの研究者が乳製品の摂取を奨めて骨粗鬆症を予防しようという栄養政策の有効性に疑問を投げかけている9−13。最近の女性(14)と青年(15-18)を対象にした前向き疫学研究も骨の健全発育に関して乳製品やカルシウム含有食品の有効性に疑問を呈している。
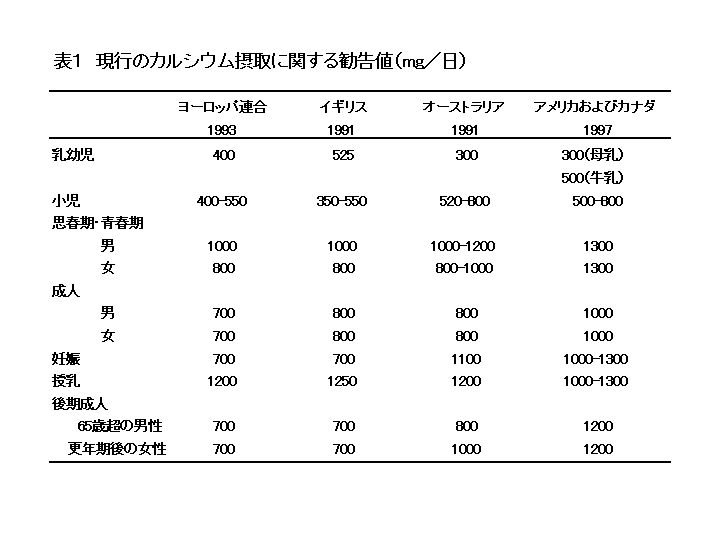
世界健康機関(WHO)は、2003年、このカルシウム・パラドックスの存在を認め、骨折率の高い国々に居住する人と世界中の50歳以上の人に対するあらゆる食品からの最小カルシウム摂取量として400-500mg/日を勧告している(19)。WHOは「世界中の人々に当てはまる摂取基準を決めることはできない」と結論づけた。また、WHOは成長段階にある人々に対しての最小カルシウム摂取量を勧告していない。このWHOの見解は、すべての人に対して生涯を通じて1日当たり800-1300mgの所要量を勧告しているアメリカ(3)やヨーロッパ大陸と
イギリスなどの乳製品大量消費国のカルシウム摂取勧告値と大きく異なっている(表1)。
乳・乳製品の摂取量が骨塩密度(BMD)、カルシウム・バランス、最大骨量(Peak Bone Mass)などの骨健康に係る指標に与える影響を定量的に観察するためにはこれらの指標に影響を及ぼす他の因子を考慮することが重要である。
食事中のタンパク質(乳製品のタンパク質も含む)はカルシウム・バランスに影響を与える。子どもの骨成長を維持し(20)、向老期になってもその骨量を保持する(21,22)ためにはタンパク質の摂取量を適量に保つことが必要である。タンパク質、就中動物性タンパク質の摂取量は尿中へのカルシウムの消失と関係が深い(23)。カルシウムの尿中消失が増すと骨からのカルシウム吸収が増加し(24)、その結果として骨折が増える(25)。多くのカルシウムの代謝実験によると、タンパク質摂取量が2倍になると、尿中へのカルシウム消失は50%増加する(26)。タンパク質の摂取が1グラム増えると、カルシウムの尿中消失を相殺するために、食事からのカルシウム摂取を理論上6ミリグラム増やさなければならない(27)。
乳製品には多量のナトリウムを含むものがある。ナトリウムとカルシウムは尿細管からの再吸収で競合するので、ナトリウムはカルシウムの尿中排泄に大きな影響を与える(28,29)。2300ミリグラムのナトリウムが腎臓から排泄されると40-60ミリグラムのカルシウムが尿中に失われる(すなわち100ミリモルのナトリウムの排泄に伴いほぼ1ミリモルのカルシウムが失われる)(30)。食塩摂取量は前思春期の子どもの骨量とは関係がないとする研究(31)もあるが、これは食事中のカルシウム対ナトリウムの比が異なっていたためと思われる。
ビタミンDはカルシウムの吸収、骨発育、骨の再生に重要な役割を果たす(32)。ビタミンDは、紫外線Bの作用で皮膚において前駆物質がビタミンD3に変化し、次いで肝臓あるいは腎臓で活性型ビタミンDになって作用を発揮する。ビタミンDの摂取量、太陽光線、ビタミンDの代謝が子どもや若年成人の骨カルシウムに及ぼす影響を調べた研究はほとんどないが、9-15歳の少女を3年間にわたって追跡したフィンランドの研究では、活性型ビタミンD前駆体の血清濃度が腰椎と大腿骨頸部の骨密度と関係していた(33)。この前駆体の血清濃度が低い少女では正常濃度の少女に比べて骨密度が4%低かった。
アメリカで市販されている牛乳にはビタミンDの前駆体が添加されている。しかし、アメリカ以外の国の牛乳あるいはアメリカでも牛乳以外の乳製品にビタミンDが添加されているとは限らない。したがってアメリカにおける乳・乳製品の骨健康に及ぼす影響を調べた研究には添加ビタミンDの影響を考慮しなければならない。
さらに、乳・乳製品の骨に与える影響を評価するには体重、思春期発達の状態、および運動量を考慮しなければならない。体重は子どもの骨のカルシウム量に強い影響を与える(34,35)。乳製品は脂肪とエネルギーの主たる供給源で、アメリカの子ども(2-18歳)の総エネルギー摂取量の18%、総脂肪摂取量の25%は乳製品に由来する(36)。したがって、乳製品が骨成長に及ぼす影響は、乳製品が体重増加を通じて骨成長に与えている影響を差し引いて考えなければならない(35)。
同様に、思春期発達の状態が骨成長に非常に大きな影響を与えるので、この状態を一定にして比較しなければ乳・乳製品の骨に与える影響を正当に評価できない(34,37-39)。
運動量もまた骨形成に大きな影響を与える(34,38,40-46)。12-18歳の身体的活動がカルシウム摂取量よりも成人になってからの骨密度(15,17)と大腿骨頸部骨折のリスク(47)に大きな影響を与えることが実証されている。
乳・乳製品の骨形成に与える影響を評価するために、本論文では1-25歳の子ども、思春期、若年成人について乳製品、他のカルシウム含有食品、およびサプリメントの消費量が骨カルシウムに与える影響を調べた研究を精査した。次の2点を明らかにすることが本論文の目的である。
1.乳・乳製品の骨形成に与える影響は他のカルシウム含有食品あるいはカルシウムサプリメントに優っているという十分な科学的証拠があるか。
2.子どもや若年成人向けの1日当たり800-1300ミリグラムという現行のカルシウム摂取基準を支持する十分な科学的根拠があるか。
方 法
メドライン(Medline:医学文献検索システム)を「牛乳」「乳製品」+「骨」「骨密度」「骨粗鬆症」のキーワドで検索してヒットする文献を収集した。ただし、集めた論文は1966年以降に発表された乳幼児を除く人間を対象にした英語論文に限定した。さらにいくつかの論文は原著論文あるいは最近の総説論文の文献欄(9,48,49)からも集めた。収集論文を精査して「牛乳」「乳製品」あるいは「総カルシウム摂取量」と「骨形成(骨カルシウムの増加)」あるいは「25歳以下の骨折(乳幼児を除く)」の関係を調べた研究論文を抽出した。この文献検索によって選びだした無作為割り付け試験研究13編、前向き研究10編、後ろ向き研究13編、横断調査研究22編を評価対象とした。
カルシウム源として「乳・乳製品由来のカルシウム」、「食事性カルシウム」、「サプリメントとしてのカルシウム」を特定するとともに、全タンパク質摂取量、ビタミンD摂取量、ナトリウム摂取量を考慮しているかあるいは少なくとも取り上げているかどうかに注目した。さらに、研究対象の性、年齢、人種に注意を払い、体重(あるいはBMI)、身体活動度、思春期発達度を考慮していない論文は本研究の研究対象から除外した。ただし、本研究では、他に骨の健康に影響を与える思われる社会経済状態、太陽光線照射量、カフェイン消費量、果物と野菜の消費量、カリウム摂取量、治療で用いられたカルシウムについては取り上げないことにした。
結 果
選択した論文のほとんどは12-21歳の白人女子を研究対象にしていた。乳あるいは乳製品を用いた無作為割り付け試験の報告はなく、男子、7歳未満の子ども、あるいは非白人女子をを対象にした論文はごく僅かであった。
横断調査
牛乳、乳製品、あるは総カルシウム(サプリメントとして摂取したカルシウムを含む)と骨健康を扱った22編の横断調査研究のうち、17編が体重、思春期発達度、身体活動度を考慮していたが(11,31,34,35,37-41,51-58)、5編の論文(59-63)は不十分であった(研究から除外)。17編のうち4編の論文(34,41,57,58)は牛乳あるは乳製品の摂取量のみを別個に推定した報告であったが、残りの13編は食事性の総カルシウム摂取量の推定値を報告していた。
牛乳あるいは乳製品の摂取量を扱った4編の論文のうち、3編は乳・乳製品の摂取量と骨密度の間に関係が認められなかったと報告している。この3編のうち1編はサウス・ダコタ州の7-15歳のフッター派教徒の女子を扱った研究で、この子らはビタミンD強化牛乳を飲んでいた。ただし、著者らはビタミンD摂取量を測定していない(57)。乳・乳製品の摂取量と骨密度の間に関係がなかったとする他の2編の論文(1編は7-11歳のオランダ人の男女に関する研究(41)、他の1編は10-26歳のオーストラリア双生児女性に関する研究(58)の研究対象はビタミンD強化牛乳を飲んでいなかった。乳製品の摂取量が骨密度を改善したという論文が1編あった。これは12-14歳の中国人女子に関する研究(34)で、平均カルシウム摂取量は356±97ミリグラム/日であった。この論文の著者は、総骨塩量(BMC)は牛乳摂取量とビタミンD摂取量の両方と関係があったが、食事性の総カルシウム摂取量とは関係がなかったと述べている。
食事性の総カルシウム摂取量と骨健康の関係を調べた13編の研究論文のうち、9編(11,31,35,37,40,51-53,55)は総カルシウム摂取量と骨密度(BMD)あるいは骨塩量(BMC)の間に関係が認められなかったとしている。そのうちの1編(11)は、カルシウム摂取量が大きく異なるヨーロッパ6カ国(最も少ないイタリアの609mq/日から最も多いフィンランドの1267mg/日)の若年女性の撓骨の骨密度を比較した研究である。年齢、身長、体重、骨面積、性成熟度(少女では思春期発達度
[タナー段階] 、成人女性では性周期)を平準化して骨密度とカルシウム摂取量の関係を比較したところ、少女でも成人女性でも有意の関係は認められなかった。他の4編の論文は食事によるカルシウム摂取量と骨密度の間に有意の関係があったと報告している。そのうちの1編はフランスの子ども(7-15歳)を対象にした研究で、脊椎骨の骨密度については有意の関係があったとしているが、大腿骨の骨密度に関しては関係がなかったという(38)。逆に二つ目の論文はニュージーランドの16歳の少女に関する研究で、カルシウム摂取量は大腿骨の骨密度の5%以下の変化を説明できたが、腰椎骨の骨密度との間に関係がなかった(56)。他の二つの総カルシウム摂取量と骨密度との間に有意の関係があったとする研究のうち、一つはオハイオの8-18歳について行われ(39)、他はコネチカットの6-18歳について行われた(54)。オハイオでの研究はカルシウム摂取量に加えて性成熟年齢と暦年齢が脊椎骨の骨密度に関係があり、コネチカットでの研究は体重と思春期発達度が骨密度を左右する大きな要因であると述べている。しかしながら、二つの研究ともに、対象者が飲んでいた牛乳はビタミンD強化牛乳であるのにビタミンD摂取量を測定していなかったり、ビタミンD摂取量を平準化していない。
これらの横断調査研究は一致して、体重(34,35,37,38,40,51,53,54,57-59,61,63)、身体活動度(54,56,57)、思春期発達度あるいは初潮発現年齢(34,37-40,51,53,54,57,59,61)、身長(40,51,53,54,56,57,59,61)、年齢(39,40,51,53,54,57,59,61)が少年・青年期の骨量の大きな決定因子であることを示している。
後ろ向き調査
選択された13編の後ろ向き調査(64-76)のうち6編(64,67,68,71,72,74)は体重、思春期発達度、身体活動度の一つ以上について考慮していなかったので、評価対象から除外した。残り7編のうち3編(65,70,76)は少年・青年期の骨量を乳製品消費量との関連で調べているが(加えて総カルシウム摂取量を調べた研究もある)、4編(55,69,73,75)は食事性総カルシウム摂取量だけを調査していた。
子どもについて乳製品消費量と骨折の関係を調べたPetridouら(70)は乳製品消費量は学童の骨折頻度と関係がなかったとし、8-16歳の骨折頻度を調べたWyshakとFrisch(76)は総カルシウム摂取量が多いと骨折頻度が少なくなるが、牛乳摂取量そのものは骨折と関係がなかったと述べている。
1編の後ろ向き研究(65)は、7−9歳の学童に6学期間牛乳を与えたものと与えなかったものについて14年後(20-23歳)に牛乳が骨成長におよぼす影響を観察した。どの部位の骨密度(BMD)と骨塩量(BMC)にも牛乳の影響は認められなかった。
Wangら(73)は子どもの頃の食事性総カルシウム摂取量と青年期(21・8-23・3歳の女性)の骨密度との関係を調べた。調査対象は、アメリカ心・肺・血液研究所の10年間にわたる「成長と健康研究」に参加したアメリカ在住の女性である。子どもの頃の食事性カルシウム摂取量は10年間に8回行われた「3日間食事記録」から推定した。693人の白人・黒人女性の脊椎骨、大腿骨頸部および全身の骨密度は思春期(平均年齢:白人12歳、黒人11・7歳)のカルシウム摂取量と関係があったが(p<0・05)、前思春期あるいは後思春期のカルシウム摂取量とは関係がなかった。一般に、前思春期の身体活動度が骨密度とプラスの関係にあった。
食事性カルシウムの摂取量を調べた研究において、Gouldingら(66)は、骨折を起こした少年少女には骨密度の低いものが多いが(75)、カルシウム摂取量は骨折を起こしたものと起こさなかったもので差がなかった(女子:骨折858mg/日、非骨折829mg/日;男子:骨折1136mg/日、非骨折1278mg/日)と述べている。したがって、食事によるカルシウムの摂取量から骨折のリスクを予測することはできない(66,75)。しかしながら、骨折を起こしたもの(女子11-15歳;男子11-13歳)の中には骨折を起こさなかったものに比べてカルシウム摂取量が減少していたものが多かった。
Parsonsら(69)は幼児期(生後から平均6・2年間)のマクロビオテック・ダイエットが青年期の骨量に与える影響を調べた。その結果、生後6年間マクロビオテック・ダイエットを摂っていたものはそうでないものに比べて青年期の骨密度が3%低かった。しかし、幼児期にマクロの食事を摂ったものは調査時点でのカルシウム摂取量が少なかったが(マクロ男性660mg/日、マクロ女性557mg/日;対照男性1064mg/日、対照女性1045mg/日)、このカルシウム摂取量は男女のいずれにおいてもどの部位の骨密度にも影響を与えていなかった。
前向き調査
10編の前向き研究が1年から14年間にわたって、体重、身体活動度、思春期発達度で補正して乳製品あるいは食事性総カルシウム摂取量が子どもあるいは青年の骨ミネラルに与える影響を調査していた(15,17,18,42-45,77-79)。このうち、Krogerらの論文(18)だけが乳製品からのカルシウム摂取量を取り扱っていた。この研究では、7-20歳の子どもあるいは青年65人のうちカルシウム摂取量が800mg/日未満が6人、800-1200mg/日が18人、1200mg/日を越えるものが41人であったが、乳製品からのカルシウム摂取量は骨密度あるいは骨塩量と有意の関係は認められなかった。
残りの9編は乳製品からのカルシウムではなく総カルシウム摂取量を取り扱っていた(42-44,79)。そのうち4編は調査期間が3年未満でカルシウム摂取量の推定は3回以下であった。体重、運動量、喫煙量で補正すると、カルシウム摂取量と骨密度の間に有意の関係は認められなかった。
他の5編の論文はカルシウム摂取量の推定を4回以上行い、3年以上経ってから骨健康との関係を調べていた(15,17,45,77,78)。9-15歳のフィンランドの少女についての研究は3年を越えて平均カルシウム摂取量と骨密度を6ヵ月間隔で測定していた(78)。いずれの時期におけるカルシウム摂取量も最終調査時点の骨密度との間に有意の関係は認められなかった。オランダの少年少女についての研究でも同様に、カルシウム摂取量は17歳時点での腰椎棘の骨密度と関係がなかった(45)。Lloydらはペンシルバニア州若年女性の健康に関する研究の結果を2000年(15)と2002年(17)に報告している。Lloydらは6年から8年にわたって6ヶ月毎に集めた3日間食事記録(2000年の報告では33回、2002年では39回の記録)に基づいてカルシウム摂取量を推定している。カルシウム摂取量は全身、大腿骨、骨盤の骨密度、骨ミネラルの増加、骨塩量のいずれとも関係がなかった。ある研究では、出生時から5年間の累積カルシウム摂取量は5歳時の骨密度と関係があったが、5歳時のカルシウム摂取量はその時点の骨密度と関係がなかった。これらの前向き研究は、体重あるいは体重増加(43-45,77)、身長(43,77)、年齢(44)、思春期発達度(18)、身体活動度(15,17,42-45)、健康レベル(15,17)、ビタミンD摂取量(78)、ナトリウム摂取量(43)が骨密度に影響を与える因子であると述べている。
無作為割り付け試験
子どもと青年を対象として乳製品の摂取量あるいはカルシウムサプリメントが骨密度に与える影響を調べた無作為割り付け試験は13編あった。そのうち観察期間が1年以上にわたる研究は12編であった。そのうち2編(80,81)が乳あるいは乳製品が骨密度に与える影響を調べ、1編(82)が乳製品とカルシウムサプリメントが骨密度に与える影響を調べていた。他の9編はカルシウムサプリメントの影響だけを観察したものであった(83-91)。
乳・乳製品が骨密度に与える影響を観察した3編の研究(80-82)はいずれも11-18歳の白人女性を対象にして行われたもので、乳・乳製品を与える前のカルシウム摂取量は725-900mg/日であった。これらのうちChanらの研究(80)だけがビタミンD摂取量と血清ビタミンD濃度を測定し、運動量を評価し、実験群と対照群の思春期発達度をマッチさせ(開始時期の性成熟段階2)、食事性カルシウム摂取量とタンパク質摂取量(カルシウム対タンパク質の摂取比)の推定を行い、体重による補正を行っている。この研究においては乳製品の摂取量を増やすことにより11歳の少女のカルシウム摂取量を728mg/日から1437mg/日に上げた。1年後の腰椎棘の骨塩密度と骨塩量の平均値は実験群と対照群の間で有意の差は認められなかった。骨塩の増加割合でみると、総骨塩量(14・2%対7・6%;p<0・001)と腰椎棘の骨蜜度(22・8%対12・9%;p<0・001)の増加率が実験群で大きかったが、大腿骨頸部と撓骨の骨密度の増加率には差が認められなかった。
他の2編の無作為割り付け試験ではビタミンD摂取量とタンパク質の摂取量で補正されていない。乳製品あるいは炭酸カルシウムの錠剤でカルシウム摂取量を2倍に増やして2年間観察したMatkovicらの介入実験(実験群のカルシウム摂取量1640mg/日、対照群750mg/日)では骨密度の実測値にも増加率にも実験群と対照群の間で差は認められなかった。Cadganらは12歳の少女に毎日1パイントの牛乳を18ヶ月飲ませた。実験終了時の骨密度の値は記述されていないが、実験群の骨密度増加率は対照群よりもわずかながら大きかった(9・6%と8・5%、p<0・017)と報告している。
カルシウムをサプリメント(カルシウム強化食品、炭酸カルシウム、クエン酸カルシウムあるいはマレイン酸カルシウムで300-1000mg/日のカルシウムを与える)として与えて骨密度あるいは骨塩量を観察した10編の論文では、1編(82)は影響なしとしているが、9編は6ヶ月から3年の観察期間で1カ所以外の骨部位の骨密度あるいは骨塩量が1-6%増えたと報告している(83-91)。これらの研究はすべて体重を記録しているが、観察期間の間に体重が変化したという報告はない。運動量と思春期発達度の両方を考慮して解析している論文は2編しかない。1編(85)は前思春期の双生児に与えたカルシウムサプリメントは3年の間に骨密度を増やしたが思春期あるいは後思春期ではその影響がなかったとしており、もう1編(90)はカルシウムを与えた最初の6ヶ月は骨密度が増えたがその後は影響が見られなくなったという。10編のうち1編(83)だけがカルシウムを与えたときの骨密度の増加が12ヶ月間持続したと報告している。
考 察
乳製品を多く摂取することによって子どもあるいは若年成人の骨の健康状態がよくなるという報告は4編の横断調査研究のうち1編、3編の後ろ向き研究では0、1編の前向き研究では0、3編の無作為割り付け試験では2編であった。無作為割り付け介入試験のうち1編だけがビタミンD摂取量を考慮して解析していた。この研究では、乳製品は骨密度の増加率に影響を与えたが、骨密度そのものには影響を与えなかった。
乳製品そのものだけでなく総カルシウム摂取量を取り上げた論文をみると、カルシウム摂取量と子どもおよび若年成人の骨密度あるいは骨塩量との間に正の関係があるとする論文は横断研究13編のうち4編、後ろ向き研究4編のうち2編、前向き研究9編のうち1編であった。無作為割り付け介入研究でこの関係を論じた論文はなかった。
カルシウム・サプリメントと骨塩密度あるいは骨塩量の関係を調べた無作為割り付け介入試験が10編あり、そのうち9編が正の関係があったとしている。
したがって、乳製品あるいは食事性のカルシウム摂取量(平均値で1日当たり160mgから2000mg)と骨健康の関係を調べた研究で何らかの方法で体重、思春期発達度、運動を補正した子ども、青年期、若年者を対象にした研究が37あったが、そのうち27研究はカルシウム摂取量と骨の健康度の間に関係を見いだせなかったということになる。
残りの9研究ではカルシウム摂取量の骨健康度に与える影響は小さかった。そのうち3研究は牛乳に添加されているビタミンDの影響が補正されていない。6研究はある部位の骨には影響があったが、他の部位では影響がみられないというものであった。
カルシウム摂取が増えると骨密度あるいは骨塩量が増えるという論文が1編あったが、これは普段の1日当たりのカルシウム摂取量が400mg未満という集団を対象にした研究であった。
身体的活動度は青年期における骨の成長・発達に影響を与える第一要因である。ペンシルバニア州若年女性の健康に関する研究(17)によると、カルシウム摂取量が青年期の骨量増加とその後の最大骨量に与える影響は5%未満であったという。対照的に、青年期の身体活動度は成人してからの骨量変動の10-22%を説明できた。フッター派教徒の女性を扱った研究でも同様に、15歳から成人するまでの間の身体活動度が成人になってからの骨塩量を決める最強の因子であるという(57)。中等度の身体活動度と骨密度との間に関係がなかったとする報告92もあるが、一般に青年期に重量保持運動プログラムに参加したものは運動しないものに比べて骨密度の増加が大きい(15,17,73,93)。
骨の成長と発達に対するカルシウムの必要量を決めるのはカルシウムの摂取量、代謝、吸収・排泄である。幼年期から青年期は他の年齢層よりもカルシウムの必要量が高く吸収率も高い(94)。尿中へのカルシウム排泄率は年齢と思春期発達度によって異なり、幼年期には1日40mg程度であるが、思春期直前には80mgほどになり、思春期後や成人では160mgに達する(95)。若年成人期に比べると青年期女性のカルシウム吸収率は高く、尿中および糞便中へのカルシウム排泄率が少ない(96)。青年期女性でも(97)、成人女性でも(98)、カルシウムの吸収率はカルシウム負荷量によって異なる。15mgのカルシウムを与えた時の吸収率は64%であるが、500mgを与えた時には28・6%に下がる。
年齢、思春期発達度、カルシウム摂取量以外にカルシウムバランスに影響を与える要因がある。どんな食品を介してカルシウムを摂取するか(27)、カルシウム塩の形状(99)、食品中のフィチン酸塩や蓚酸塩などの吸収阻害物質の存在(100,101)、ビタミンD(32)などによってカルシウムの吸収は影響を受ける。さらに、カルシウムの尿中排泄は食事によって尿の酸性度がどうなるか、タンパク質(とくに動物性タンパク質)の摂取量(102)、食事のナトリウム含有量(30,101)、食事のカリウム含有量(103)、そしておそらくカフェイン摂取量と喫煙によって影響を受ける。
カルシウムバランスに影響を与える摂取量などの要因は少なくともある条件のもとでは骨発達に一定の役割を演じているだろう。毎日のカルシウム摂取量が400mg未満の集団を対象とした研究では、この水準を越えるカルシウムが骨塩量の増加に効果があった(34)。さらに、10の無作為割り付け介入研究のうち9研究がサプリメントとして与えた1日300-1000mgのカルシウムが子どもと青年の骨発達に僅かではあるが有意の影響(骨塩密度あるいは骨塩量が1-6%増加)を与えたと報告している。しかし、その影響は一過性であった。カルシウムサプリメントが子どもと青年の骨におよばす影響を調べた研究は短いものでも1年間サプリメントを与えたが、サプリメントを止めてから12ヶ月間にわたって骨密度の増加が持続した研究は2研究しかない(83,91)。ほとんどの研究と同様にペンシルバニア州若年女性の健康に関する研究でもサプリメント投与中(12歳-16歳)に6%増加した骨密度は青年期後期まで持続しなかった(17)。Slemendaら(104)や他の研究者たち(48,50)はカルシウムサプリメントは骨カルシウムの置き換えを抑えることによって一時的に骨密度を増大させるのではないかと述べている。
カルシウムサプリメントを用いた介入研究の結果をそのまま乳・乳製品を用いた研究や食事性総カルシウム摂取量を扱った研究に当てはめることはできない。乳・乳製品はタンパク質やナトリウムを含んでいるし、場合によってはビタミンDが添加されている。これらがカルシウムバランスや骨のミネラル化に影響を与え、乳製品の骨に与える影響が変化する。とくにタンパク質とナトリウムがカルシウム排泄を促す方向に働く。Weaverらの計算(27)によれば、タンパク質やナトリウムによってカルシウムの尿中排泄が増えても、牛乳・乳製品は骨のミネラル化に有利に働くということになる。しかしながら、今までの臨床研究、前向き・後ろ向き疫学研究、横断研究のいずれも、食事性総カルシウム摂取量とりわけ乳・乳製品からのカルシウム摂取量を増やしても子どもや青年期の骨健康に有益であるという一致した証拠を提出していない。
乳・乳製品およびカルシウム摂取量と骨健康に関する最近の総説論文はカルシウムバランスと骨ミネラル増加に関与する要因に焦点を当てているが、その結論は互いに相反している。WeinsierとKrumdieck(9)は、乳製品消費量と骨健康の関係を取り上げた57編の論文を評価して、骨健康のために米国一般人に乳製品を毎日摂取するよう勧告するほどの証拠はないと結論している。それとは対照的に、Heaney(49)は139編のカルシウム摂取量(サプリメントを含む)と子どもおよび成人の骨健康に関する論文を調べて、とくに乳製品からのカルシウムが骨健康に関与しているという証拠があると結論づけている。
とくに子どもと青年期における骨健康の決定要因に焦点を当てた総説論文で、Bachrach(105)は、食事からあるいはサプリメントとして摂ったカルシウムは短期間で効果があったとしても、それが将来の臨床的骨粗鬆症の意味ある減少につながるかどうか判らないと述べている。子どもの骨健康とカルシウム摂取量の関連を詳細に調べた総説論文(48)はカルシウム摂取を増やして骨密度(骨皮質の骨密度)が増加するのは普段カルシウムの摂取量が少ない子どもで認められるが、その効果は投与期間を越えては持続しないと述べている。
カルシウム摂取量が非常に少ない(例えば1日400mg未満)のはよくないかも知れないが(35,69)、適正に行われた研究のほとんどは、カルシウム摂取量が1日400-500mgを越えていれば乳製品の摂取量を増やしても(17,42,58,59,66,71,76,80)あるいはカルシウムの摂取量を増やしても(10,14,16,32,36,38,41,43-46,52-54,56,67,70,75-77)、子どもと青年期あるいはそれ以後の骨密度や骨折頻度に関係ないことを示している。
今までの研究でみる限り、牛乳がカルシウムの摂取源として優れているという証拠はない。実際、骨健康に対する食事性因子に関する研究で乳製品だけを取り上げた研究は少ないのである。1994年に出たNIH(米国国立衛生研究所)の最適カルシウム摂取量に関する合意文書(2)は牛乳がカルシウムの摂取源として優れていることをはっきり述べているわけではないが、政府や産業界はあたかも「牛乳が優れている」と述べているかのように解釈して宣伝を繰り広げている。例えば、子どもの健康と発達に関する国立研究所はその「ミルク事情(Milk
Matters)」において、カルシウム含有量が多い・吸収もよいという理由で低脂肪・無脂肪牛乳が子どものカルシウム摂取に最も優れているというキャンペーンを行っている(106)。牛乳や乳製品はカルシウムを多く含んでいるが、そのカルシウムが利用されるには多くの要因が関係している。例えば、乳製品のカルシウムは濃緑色野菜に含まれているカルシウムほどには吸収されず、その吸収率はカルシウム・サプリメント、カルシウム添加飲料、カルシウム入り豆腐、さつまいも、豆類のカルシウムと同程度である(27)。乳製品にはタンパク質とナトリウムが多い。ある種の乳製品(プロセスチーズなど)は、ナトリウム、含硫アミノ酸、リンが多いために、尿中に排泄されるカルシウムを増量する(26)。たしかに、乳製品に含まれているカルシウムの絶対量はカルシウムの豊富な植物性食品よりも多いだろう。しかし、吸収率を考慮すると、一定量のカルシウムを取り込むのに必要な植物食品の量は乳製品に比べてそれほど多いわけではない。牛乳で摂れるほどのカルシウムはほぼ等量の野菜からも穀物からも摂れるのである。例えば、200グラムの調理済みケールあるいは蕪菜(ターニップ)、2箱の即席オートミール、140グラムほどの豆腐、340グラムのブロッコリから摂れるカルシウムは200ミリリットルの牛乳からのカルシウムにほぼ等しい。
カルシウム摂取量の勧告値は短期間のバランス試験か、長期であっても1−3年のカルシウム投与試験の結果に基づいている。乳製品やサプリメントで子どものカルシウム摂取量を多くして骨塩量や骨塩密度に与える影響を観察した研究の多くは他の骨成長に与える要因を適切に評価していない。たとえカルシウムを多くして骨量や骨密度が増えても、それが成人してからも持続するという証拠はない。
現在のところ、牛乳・乳製品を増やして子どもの骨密度を高めるという栄養ガイドラインを支持する証拠はない。乳製品が若年者の骨成長に与える影響を調べた研究は白人女性を対象にしたものが多く、男の子、7歳未満の子ども、あるいは非白人の若年女性の骨成長に関するデータはほとんどない。
文 献
1. National
Institute of Health. Consensus Development Conference Statement. Osteoporosis
Prevention, Diagnosis, and Therapy. Bethesda, MD: National Institute of
Health; 2000:27-29.
2. National Institute of Health. Consensus Development Panel on Optimal
Calcium Intake. JAMA 1994;272:1942-1948.
3. Institute of Medicine. Dietary Reference Intakes for Calcium, Phosphorous,
Magnesium, Vitamin D, and Fluoride. Standing Committee on the Scientific
Evaluation of Dietary Reference Intakes. Washington, DC: National Academy
Press; 1997.
4. US Department of Agriculture. The Food Guide Pyramid. Hyattsville,
MD: Human Nutrition Information Service; 1996 [Home and Garden Bull. No.
252]
5. US Department of Agriculture and US Department of Health and Human
Services. Nutrition and Your Health: Dietary Guidelines for Americans.
5th ed. Washington, DC: US Department of Agriculture and US Department
of Health and Human Services; 2000 [Home and Garden Bull. No. 232]
6. Gerri or S. Nutrient Content of the US Food Supply. Home Economics
Research Report no. 53. Washington, DC: United States Department of Agriculture,
Center of Nutrition Policy and Promotion; 2001.
7. Abelow BJ, Holford TR, Insogna KL. Cross-cultural association between
dietary animal protein and hip fracture: a hypothesis. Calcif Tissue Int
1992;50:14-18.
8. Report of a Joint Food and Agriculture Organization of the United Nations
/ World Food Organization of the United Nations Expert Consultation. Human
vitamin and mineral requirements. Bangkok, Thailand; September 1998. Available
at: ftp://ftp.fao.org/es/esn/nutrition/Vitrni/vitrni.html
9. Weinsier RL, Krumdieck CL. Dairy food and bone health: examination
of the evidence. Am J Clin Nutr 2000;72:681-689.
10. Hegsted DM. Fractures, calcium, and the modern diet. Am J Clin Nutr
2001;74:571-573.
11. Kardinaal AF, Ando S, Charles P, et al. Dietary calcium and bone density
in adolescent girls and young women in Europe. J Bone Miner Res 1999;14:583-592.
12. Seppa K. Bone density and milk. Consider fat as well as calcium intake.
BMJ 1994;308:1556.
13. Avenell A. Bone density and milk. Exercise and body size influence
bone density. BMJ 1994:308:1566.
14. Feskanich D, Willett WC, Colditz GA. Calcium, vitamin D, milk consumption,
and hip fractures: a prospective study among postmenopausal women. Am
J Clin Nutr 2003;77:504-511.
15. Lloyd T, Chinchilli VM, Johonson-Rollings N, Kieselhorst K, Eggli
DF, Marcus R. Adult female hip bone density reflects teenage sports-exercise
patterns but not teenage calcium intake. Pediatrics 2000;106:40-44.
16. Lloyd T, Taylor DS. Calcium intake and peak bone mass. J Am Med Womens
Assoc 2001;56:49-52, 72.
17. Lloyd T, Beck TJ, Lin HM, et al. Modifiable determinants of bone status
in young women. Bone 2002;30:416-421.
18. Kroger H, Kotaniemi A, Kroger L, Alhava E. Development of bone mass
and bone density of the spine and femoral neck-a prospective study of
65 children and adolescents. Bone Miner 1993;23:171-182.
19. Joint Food and Agriculture Organization of the United Nations / World
Food Organization of the United Nations Expert Consultation on Diet, Nutrition,
and the Prevention of Chronic Diseases. WHO Technical Report Series 916.
Geneva, Switzerland: World Health Organization; 2003. Available at: www.who.int/hpr/NPH/docs/who_fao_expert_report.pdf
20. Cromer B, Harel Z, Adolescents at increased risk for osteoporosis?
Clin Pediatr (Phila) 2000;39:565-574.
21. Hannan MT, Tucker KL, Dawson-Hughes B, Cupples LA, Felson DT, Kiel
DP. Effect of dietary protein on bone loss in elderly men and women: the
Framingham Osteoporosis Study. J Bone Miner Res 2000;15:2504-2512.
22. Promislow JH, Goodman-Gruen D, Slymen DJ, Barrett-Connor E. Protein
consumption and bone mireal density in the elderly: the Rancho Bernardo
Study. Am J Epidemiol 2002;155:636-644.
23. Breslau NA, Brinkley L, Hill KD, Pak CY. Relationship of animal protein-rich
diet to kidney stone formation and calcium metabolism. J Clin Endocrinol
Metab 1988;66:140-146.
24. Barzel ES, Massey LK. Excess dietary protein can adversely affect
bone. J Nutr 1998;128:1051-1053.
25. Frassetto L, Morris RC Jr, Sellmeyer DE, Todd K, Sebastian A. Diet,
evolution and aging _ the pathophysiologic effects of the post-agricultural
inversion of potassium-to-sodium and base-to-chloride ratios in the human
diet. Eur J Nutr 2001;40-200-213.
26. Heaney RP, Recker RR. Effects of nitrogen, phosphorus, and caffeine
on calcium balance in women. J Lab Clin Med 1982;99:46-55.
27. Weaver CM, Proulx WR, Heaney R. Choices for achieving adequate dietary
calcium with a vegetarian diet. Am J Clin Nutr 1999;70:543S-548S.
28. Nordin BE. Calcium and osteoporosis. Nutrition 1997;13:664-686.
29. Matkovic V, Ilich JZ, Andon MB, et al. Urinary calcium, sodium, and
bone mass of young females. Am J Clin Nutr 1995;62:417-425.
30. Nordin BE, Need AG, Morris HA, Horowitz M. The nature and significance
of the relationship between urinary sodium and urinary calcium in women.
J Nutr 1993;123:1615-1622.
31. Jones C, Riley MD, Whiting S. Association between urinary potassium,
urinary sodium, current diet, and bone density in prepubertal children.
Am J Clin Nutr 2001;73:839-844.
32. Holick MF. Vitamin D and bone health. J Nutr 1996;126:1159S-1164S.
33. Lehtonen-Veromaa M, Mottonen T, Nuotio I, Irjala K, Viikari J. The
effect of conventional vitamin D(2) supplementation on serum 25(OH)D concentration
is weak among perpubertal Finnish girls: a 3-y prospective study. Eur
J Clin Nutr 2002;56:431-437.
34. Du XQ, Greenfield H, Fraser DR, Ge KY, Liu ZH, He W. Milk consumption
and bone mineral content in Chinese adolescent girls. Bone 2002;30:521-528.
35. Moro M, van der Meulen MC, Kiratli BJ, Marcus R, Bacharach LK, Carter
DR. Body mass is the primary determinant of midfemoral bone acquisition
during adolescent growth. Bone 1996;19:518-526.
36. Subar AF, Krebs-Smith SM, Cook A, Kahle LL. Dietary sources of nutrients
among US children, 1989-1991. Pediatrics 1998;102:913-923.
37. Maggiolini M, Bonofiglio D, Giorno A, et al. The effect of dietary
calcium intake on bone mineral density in healthy adolescent girls and
women in southern Italy. Int J Epidemiol 1999;28:479-484.
38. Ruiz JC, Mandel C, Garabedian M. Influence of spontaneous calcium
intake and physical exercise on the vertebral and femoral bone mineral
density of children and adolescents. J Bone Miner Res 1995;10:675-682.
39. Sentipal JM, Wardlaw GM, Mahan J, Matkovic V. Influence of calcium
intake and growth indexes on vertebral bone mineral density in young females.
Am J Clin Nutr 1991;54:425-428.
40. Uusi-Rasi K, Haapasalo H, Kannus P, et al. Determinants of bone mineralization
in 8 to 20 year old Finnish females. Eur J Clin Nutr 1997;51:54-59.
41. VandenBergh MF, DeMan SA, Witteman JC, Hofman A, Trouerbach WT, Grobbee
DE. Physical activity, calcium intake, and bone mineral content in children
in the Netherlands. J Epidemiol Community Health 1995;49:299-304.
42. Bass S, Pearce G, Bradney M, et al. Exercise before puberty may confer
residual benefits in bone density in adulthood: studies in active prepubertal
and retired female gymnasts. J Bone Miner Res 1998;13:500-507.
43. Gunnes M, Lehmann EH. Physical activity and dietary constituents as
predictors of forearm cortical and trabecular bone gain in healthy children
and adolescents: a prospective study. Acta Pediatr 1996;85:19-25.
44. Valimaki MJ, Karkkainen M, Lamberg-Allardt C, et al. Exercise, smoking,
and calcium intake during adolescence and early adulthood as determinants
of peak bone mass. Cardiovascular Risk in Young Finns Study Group. BNJ
1994;309:230-235.
45. Welten DC, Kemper HC, Post GB, et al. Weight-bearing activity during
youth us a more important factor for peak bone mass than calcium intake.
J Bone Miner Res 1994;9:1089-1096.
46. Hara S, Yanagi H, Amagai H, Endoh K, Tsuchiya S, Tomura S. Effect
of physical activity during teenage years, based on type of sport and
duration of exercise, on bone mineral density of young, premenopausal
Japanese women. Calcif Tissue Int 2001;68:23-30.
47. Nieves JW, Grisso JA, Kelsey JL. A case-control study of hip fracture:
evaluation of selected dietary variables and teenage physical activity.
Osteoporos Int 1992;2:122-127.
48. Wosje KS, Specker BL. Role of calcium in bone health during childhood.
Nutr Rev 2000;58:253-268.
49. Heaney RP. Calcium, dairy products and osteoporosis. J Am Coll Nutr
2000;19:83S-99S.
50. Heaney RP. The bone-remodeling transient: implications for the interpretation
of clinical studies of bone mass change. J Bone Miner Res 1994;9:1515-1523.
51. Bonofiglio D, Maggiolini M, Marsico S, et al. Critical years and stages
of puberty for radial bone mass apposition during adolescence. Horm Metab
Res 1999;31:478-482.
52. Bonofiglio D, Maggiolini M, Catalano S, et al. Parathyroid hormone
is elevated but bone markers and density are normal in young female subjects
who consume inadequate dietary calcium. Br J Nutr 2000;84:111-116.
53. Katz man DK, Bachrach LK, Carter DR, Marcus R. Clinical and anthropometric
correlates of bone mineral acquisition in healthy adolescent girls. J
Clin Endocrinol Metab 1991;73:1332-1339.
54. Rubin K, Gendreau P, Sarfarazi M, Mendola R, Dalsky G. Predictors
of axial and peripheral bone mineral density in healthy children and adolescents,
with special attention to the role of puberty. J Pediatr 1993;123:863-870.
55. Taha W, Chin D, Silverberg AL, Lashiker L, Khateeb N, Anhalt H. Reduced
spinal bone mineral density in adolescents of an Ultra-Orthodox Jewish
community in Brooklyn. Pediatrics 2001;107(5). Available at: www.pediatrics.org/cgi/content/full/107/5/e79
56. Turner JG, Gilchrist NL, Ayling EM, Hassall AJ, Hooke EA, Sadler WA.
Factors affecting bone mineral density in high school girls. N Z Med J
1992;105:95-96.
57. Wosje KS, Binkley TL, Fahrenwald NL, Specker BL. High bone mass in
a female Hutterite population. J Bone Miner Res 2000;15:1429-1436.
58. Young D, Hopper JL, Nowson CA, et al. Determinants of bone mass in
10- to 26-year-old females; a twin study. J Bone Miner Res 1995;10:558-567.
59. Chan GM. Dietary calcium and bone mineral status of children and adolescents.
Am J Dies Child 1991;145:631-634.
60. Kristinsson JO, Valdimarsson O, Steingrimsdottir I, Sigurdsson G.
Relation between calcium intake, grip strength and bone mineral density
in the forearms of girls aged 13 and 15. J Intern Med 1994;236:386-390.
61. Kr_ger H, Kotaniemi A, Kroger L, Vainio P, Alhava E. Bone densitometry
of the spine and femur in children by dual^energy x-ray absorptiometry.
Bone Miner 1993;23:195-206.
62. Lee WT, Leung SS, NG MY, et al. Bone mineral content of two populations
of Chinese children with different calcium intakes. Bone Miner 1993;23:195-206.
63. Tsukahara N, Sato K, Ezawa I. Effects of physical characteristics
and dietary habits on bone mineral density in adolescent girls. J Nutr
Sci Vitaminol (Tokyo) 1997;43:643-655.
64. Black RE, Williams SM, Jones IE, Goulding A. Children who avoid drinking
cow milk have low dairy calcium intakes and poor bone health. Am J Clin
Nutr 2002; 76:675-680.
65. Fehily AM, Coles RJ, Evans WD, Elwood PC. Factors affecting bone density
in young adults. Am J Clin Nutr 1992;56:579-586.
66. Goulding A, Cannan R, Williams SM, Gold EJ, Taylor RW, Lewis-Barnard
NJ. Bone mineral density in girls with forearm fractures. J Bone Mineral
Res 1998; 23:143-148.
67. Henderson RC, Hayes PR. Bone mineralization in children and adolescents
with a milk allergy. Bone Miner 1994;27:1-12.
68. Infante D, Tormo R. Risk of inadequate bone mineralization in diseases
involving long-term suppression of dairy products. J Pediatr Gastroenterol
Nutr 2000;30:310-313.
69. Parsons TJ, van Dusseldorp M, van der Vliet M, van de Werken K, Schaafsma
G, Van Staveren WA. Reduced bone mass in Dutch adolescents fed a macrobiotic
diet in early life. J Bone Miner Res 1997;12:1486-1494.
70. Petridou E, Karpathios T, Dessypris N, Simou E, Trichopoulos D. The
role of diary products and no alcoholic beverages in bone fractures among
school age children. Scand J Soc Med 1997; 25:119-125.
71. Pettifor JM, Moodley GP. Appendicular bone mass in children with a
high prevalence of low dietary calcium intakes. J Bone Miner Res 1997;12:1824-1832.
72. Teegarden D, Lyle RM, Proulx WR, Johnston CC, Weaver CM. Previous
milk consumption is associated with greater bone density in young women.
Am J Clin Nutr 1999;69:1014-1017.
73. Wang MC, Crawford PB, Hudes M, Van Loan M, Siemering K, Bachrach LK.
Diet in midpuberty and sedentary activity in prepuberty predict bone mass.
Am J Clin Nutr 2003;77:495-503.
74. Coulding A, Rockell JE, Black RE, Grant AM, Jones IE, Williams SM.
Children who avoid drinking cow’s milk are at increased risk for prepubertal
bone fracture. J Am Diet Assoc 2004;104:250-253.
75. Coulding A, Jones IE, Taylor RW, Williams SM, Manning PJ. Bone mineral
density and body composition in boys with distal forearm fracture: a dual-energy
x-ray absorptiometry study. J Pediatr 2001;139:509-515.
76. Wishek G, Frisch RE. Carbonated beverages, dietary calcium, the dietary
calcium/phosphorous ratio, and bone fractures in girls and boys. J Adolesc
Health 1994;15:210-215.
77. Lee WT, Leung SS, Lui SS, Lau J. Relationship between long-term calcium
intake and bone mineral content of children aged from birth to 5 years.
Br J Nutr 1993;70:235-248.
78. Lehtonen-Veromaa MK, Mottonen TT, Nuotio IO, Irjala KM, Leino AE,
Viikari JS. Vitamin D and attainment of bone peak mass among peripubertal
Finnish girls: a 3-y prospective study. Am J Clin Nutr 2002;76:1446-1453.
79. Jones G, Riley MD, Dwyer T. maternal diet during pregnancy is associated
with bone mineral density in children: a longitudinal study. Eur J Clin
Nutr 2000;54:749-756.
80. Chan GM, Hoffman K, McMurry M. Effects of dairy products on bone and
body composition in pubertal girls. J Pediatr 1995;126:551-556.
81. Cadogan J, Eastell R, Jones N, Barker ME. Milk intake and bone mineral
acquisition in adolescent girls: randomized, controlled intervention trial.
BMJ 1997; 315:1255-1260.
82. Matkovic V, Fontana D, Tominac C, Goel P, Chesnut CH III. Factors
that influence peak bone mass formation: a study of calcium balance and
the inheritance of bone mass in adolescent females. Am J Clin Nutr 1990;52:578-588.
83. Bonjour JP, Carrie AL, Ferrari S, et al. Calcium-enriched foods and
bone mass growth in prepubertal girls: randomized, double-blind, placebo-controlled
trial. J Clin Invest 1997;99:1287-1294.
84. Dibba B, Prentice A, Ceesay M, Stirling DM, Cole TJ, Poskitt EM. Effect
of calcium supplementation on bone mineral accretion in Gambian children
accustomed to a low-calcium diet. Am J Clin Nutr 2000;71:544-549.
85. Johnston CC Jr, Miller JZ, Slemenda CW, et al. Calcium supplementation
and increases in bone mineral density in children. N Engl J Med 1992;327:82-87.
86. Lee WT, Leung SS, Wang SH, et al. Double-blind, controlled calcium
supplementation and bone mineral accretion in children accustomed to a
low-calcium diet. Am J Clin Nutr 1994;60:744-750.
87. Lee WT, Leung SS, Leung DM, Tsang HS. Lau J, Cheng JC. A randomized
double-blind controlled calcium supplementation trial, and bone and height
acquisition in children. Br J Nutr 1995;74:125-139.
88. Lloyd T, Andon MB, Rollings N, et al. Calcium supplementation and
bone mineral density in adolescent girls. JAMA 1993;270:841-844.
89. Lloyd T, Martel JK, Rollings N, et al. The effect of calcium supplementation
and Tanner stage on bone density, content and area in teenage women. Osteoporos
Int 1996;6:276-283.
90. Nowson CA, Green RM, Hopper JL, et al. A co-twin study study of the
effect of calcium supplementation on bone density during adolescence.
Osteoporos Int 1997;7:219-225.
91. Stear SJ, Prentice A, Jones SC, Cole TJ. Effect of a calcium and exercise
intervention on the bone mineral status of 16-18-y-old adolescent girls.
Am J Clin Nutr 2003;77:985-992.
92. Mazess RB, Barden HS. Bone density in premenopausal women: effects
of age, dietary intake, physical activity, smoking, and birth-control
pills. Am J Clin Nutr 1991;53:132-142.
93. Matkovic V. Calcium metabolism and calcium requirements during sleletal
remodeling and consolidation of bone mass. Am J Clin Nutr 1991;54:245S-260S.
94. Peacock M. Calcium absorption efficiency and calcium requirements
in children and adolescents. Am J Clin Nutr 1991;54:261S-265S.
95. Weaver CM, Martin BR, Plawecki KL, et al. Differences in calcium metabolism
between adolescent and adult females. Am J Clin Nutr 1995;61:577-581.
96. O’Brien KO, Abrams SA, Liang LK, Ellis KJ, Gagel RF. Increased efficiency
of calcium absorption during short periods of inadequate calcium intake
in girls. Am J Clin Nutr 1996;63:579-583.
97. Heaney RP, Weaver CM, Fitzsimmons ML. Influence of calcium load on
absorption fraction. J Bone Miner Res 1990;5:1135-1138.
98. Levenson DI, Bockman RS. A review of calcium preparations. Nutr Rev
1994;52:221-232.
99. Heaney RP, Weaver DM, Fitzsimmons ML. Soybean phytate content: effect
on calcium absorption. Am J Clin Nutr 1991;53:745-747.
100. Weaver CM, Heaney RP, Nickel KP, Packard PI. Calcium bioavailability
from high oxalate vegetables: Chinese vegetables, sweet potatoes and rhubarb.
J Food Sci 1997;62:524-525.
101. Sellmeyer DE, Stone KL, Sebastian A, Cummings SR. A high ratio of
dietary animal to vegetable protein increases the rate of bone loss and
the risk of fracture in postmenopausal women. Study of Osteoporotic Fractures
Research Group. Am J Clin Nutr 2001;73:118-122.
102. Massey LK. Dietary animal and plant protein and human bone health;
a whole foods approach. J Nutr 2003;133:862S-865S.
103. Slemenda CC, Hui SL, Longcope C, Johnston CC Jr. Cigarette smoking,
obesity, and bone mass. J Bone Miner Res 1989;5:737-741.
104. Slemenda CC, Peacock M, Hui S, Zhou L, Johnston CC. Reduced rates
of skeletal remodeling are associated with increased bone mineral density
during the development of peak skeletal mass. J Bone Miner Res 1997;12:676-682.
105. Bachrach LK. Acquisition of optimal bone mass in childhood and adolescence.
Trends Endocrinorol 2001;12:22-28.
106. Milk Matters. Calcium Education Campaign. National Institute of Child
Health and Development; 2004. Available at: nichd.nih.gov/milk/milk.cfm